Το γλοίωμα είναι πρωτοπαθής όγκος του εγκεφάλου, που περιλαμβάνει μορφές όπως το αστροκύτωμα, το ολιγοδενδρογλοίωμα και το γλοιοβλάστωμα, με μεγάλη ετερογένεια και διαφορετική βιολογική και κλινική συμπεριφορά. Τα επενδυμώματα ή γαγγλιογλοιώματα μπορούν να θεωρηθούν επίσης υπότυποι γλοιωμάτων. Μια απλουστευμένη κατηγοριοποίηση των παραπάνω όγκων γίνεται ανάλογα με τον βαθμό κακοήθειας τους κατά ΠΟΥ ( Παγκόσμιο Οργανισμό Υγείας), που παραδοσιακά τους ταξινομούσε σε χαμηλής ή υψηλής κακοήθειας γλοιώματα. Σύμφωνα με την τελευταία επιθεώρηση του ΠΟΥ το 2021, ο βαθμός κακοήθειας δεν καθορίζεται πλέον μόνο με ιστολογικά κριτήρια αλλά είναι απαραίτητος και ένας επιπλέον μοριακός έλεγχος (Louis DN, 2021).
Σύμφωνα με το μητρώο καταγραφής των του κεντρικού νευρικού συστήματος των ΗΠΑ, τα γλοιώματα αποτελούν το 26% όλων των πρωτοπαθών όγκων του εγκεφάλου (Ostrom QT, 2023) και είναι οι δεύτεροι πιο συχνοί πρωτοπαθείς όγκοι μετά τα μηνιγγιώματα. Η ετήσια επίπτωση των γλοιωμάτων, δηλ. ο αριθμός των νέων περιστατικών με γλοιώματα ανά 100.000 πληθυσμό ανά έτος ανέρχεται σε περίπου 6 νέους ασθενείς/100.000 κατοίκους/έτος τόσο σε αμερικανικά όσο και ελληνικά καταγραφικά συστήματα (Gousias K, 2009; Ostrom QT, 2023).
Ο Καθηγητής Νευροχειρουργικής Δρ. Γούσιας έχει υπερεξειδίκευση στη χειρουργική αντιμετώπιση γλοιωμάτων, αφού έχει πραγματοποιήσει περισσότερες από 800 επεμβάσεις σε ασθενείς με γλοιώματα στην Γερμανία. Αυτήν την τεχνογνωσία, που παρείχε επί σειρά ετών σε κορυφαία κέντρα Νευροχειρουργικής της Γερμανίας, όπου θήτευσε τα τελευταία 5 χρόνια ως διευθυντής μεγάλης Aκαδημαϊκής Νευροχειρουργικής Κλινικής του Πανεπιστημίου του Münster, πλέον την προφέρει και στην Ελλάδα, μέσω του Ιατρικού Κέντρου Αθηνών.
Στα πλαίσια της αναγνώρισης του κλινικού και ακαδημαϊκού του έργου πάνω στα γλοιώματα έχει επιλεγεί από το 2023 ως ειδήμων χειρουργό όγκων εγκεφάλων στην 15μελή επιτροπή της Ευρωπαϊκής Νευροχειρουργικής Εταιρείας (EANS Neurooncology section).
Τα γλοιώματα χαρακτηρίζονται από τον υπέρμετρο πολλαπλασιασμό των στηρικτικών κυττάρων του εγκεφαλικού, δηλ. των νευρογλοιακών κυττάρων. Τα ακριβή αίτια της ανάπτυξης των γλοιωμάτων ωστόσο, δεν είναι πλήρως κατανοητά. Γενικά τα γλοιώματα χαμηλής κακοήθειας εμφανίζονται σε νεότερους ασθενείς, ενώ κακοήθεις όγκοι, όπως τα γλοιοβλαστώματα εμφανίζονται συνήθως σε ηλικίες άνω των 55 ετών.
Υπάρχουν λίγοι γνωστοί καθορισμένοι παράγοντες κινδύνου. Η ακτινοβολία, ιδιαίτερα η ιονίζουσα ακτινοβολία, έχει αναγνωριστεί ως πιθανός παράγοντας κινδύνου για την ανάπτυξη όγκων του εγκεφάλου όπως το γλοιοβλάστωμα. Άτομα που έχουν εκτεθεί σε ορισμένες πηγές ακτινοβολίας, όπως ιονίζουσα ακτινοβολία, επαγγελματικά ή ιατρικά, όπως η ακτινοθεραπεία για θεραπεία καρκίνου, μπορεί να διατρέχουν αυξημένο κίνδυνο να αναπτύξουν αυτόν τον τύπο όγκου.
Έπειτα, υπάρχει η τάση για ανάπτυξη των όγκων αυτών στα πλαίσια διαφόρων συνδρόμων , όπως για παράδειγμα στην περίπτωση της νευροϊνωμάτωσης, μια γενετική διαταραχή που επηρεάζει το νευρικό σύστημα. Ωστόσο, αυτοί οι παράγοντες κινδύνου δεν ισχύουν για τους περισσότερους ασθενείς.
Η τρέχουσα εστίαση είναι στην οικογενειακή προδιάθεση, δηλαδή στην τάση μιας οικογένειας ή ορισμένων μελών της οικογένειας να αναπτύξουν μια συγκεκριμένη ασθένεια ή διαταραχή (Melin BS, Gousias K, 2017; Kinnersley B, Gousias K, 2015A; Kinnersley B, Gousias K, 2015B; Jacobs DI, Gousias K, 2012). Αυτή η τάση επηρεάζεται από γενετικούς παράγοντες και μπορεί να έχει ως αποτέλεσμα τα μέλη της οικογένειας να έχουν αυξημένο κίνδυνο να αναπτύξουν μια συγκεκριμένη ασθένεια με βάση γενετικές προδιαθέσεις. Περισσότερα από 50 γονίδια έχουν ήδη αναγνωριστεί για το σκοπό αυτό (Enciso-Mora V, Gousias K, 2013A; Enciso-Mora V, Gousias K, 2013B; Kinnersley B, Gousias K, 2016; Sanson M, Gousias K, 2011). Αυτή η αιτιολογία είναι επίσης υπεύθυνη μόνο για περίπου το 4% των περιπτώσεων. (Simon M, Gousias K, 2011). Επομένως, η αιτία του όγκου παραμένει ασαφής για τη συντριπτική πλειοψηφία των ασθενών.
Ο όγκος ανακαλύπτεται πολύ σπάνια ως τυχαίο εύρημα. Ο ασθενής εμφανίζει συνήθως διάφορα νευρολογικά συμπτώματα, η σοβαρότητα των οποίων εξαρτάται από το μέγεθος και τη θέση του όγκου. Τα τυπικά συμπτώματα είναι για παράδειγμα, επιληπτικές κρίσεις, νευρολογικά ελλείμματα όπως παράλυση, διαταραχές στην ομιλία ή στην κατανόηση, οπτικές διαταραχές ή απλά διαταραχές προσωπικότητας και βυθιότητα. Συχνά εμφανίζονται επίσης μη ειδικά συμπτώματα, όπως πονοκέφαλοι ή ζάλη.
Η κλινική εικόνα και το ιστορικό θέτουν την υποψία για μια χωροκατακτητική εξεργασία, η οποία διερευνάται με απεικονιστικές μεθόδους, όπως αξονική τομογραφία ή μαγνητική τομογραφία. Το τελευταίο είναι το διαγνωστικό μέσο εκλογής.
Η υποψία για γλοίωμα μπορεί να εδραιωθεί εδώ. Ειδικές μαγνητικές, όπως φασματοσκοπία βοηθούν στην μελέτη του μεταβολισμού των όγκων, δίνοντας κάποια επιπλέον πληροφορία για να υποψιαστούμε έναν όγκο χαμηλής ή υψηλής κακοήθειας.
Ωστόσο η σίγουρη και τελική διάγνωση των όγκων γίνεται μέσω της βιοψίας και της επακόλουθης ιστολογικής και μοριακής εξέτασης, καθώς στην συντριπτική πλειοψηφία τους, ενδείκνυται η χειρουργική αφαίρεσή τους, όταν αυτό είναι δυνατό να γίνει με ασφάλεια.
Η πρόγνωση των ασθενών με γλοιώματα εξαρτάται από πολλούς παράγοντες, τόσο από τα βιολογικά χαρακτηριστικά του ίδιου του όγκου (Gousias K, 2010; Gousias K, 2012; Gousias K, 2013; Gousias K, 2014A; Gousias K, 2014B; Martinez R, Gousias K, 2018; Gousias K, 2022)αλλά κυρίως από τον βαθμό αφαίρεσης του όγκου κατά τη διάρκεια του χειρουργείου (Gousias K, 2014C; Gousias K, 2018).
Με εξαίρεση τα πολύ σπάνια καλοήθη γλοιώματα βαθμού κακοήθειας 1 κατά ΠΟΥ, τα οποία θα μπορούσαν απλά να παρακολουθηθούν ανά συγκεκριμένα χρονικά διαστήματα μέσω μαγνητικών τομογραφιών, τα υπόλοιπα γλοιώματα αναπτύσσονται διηθητικά και απαιτούν τουλάχιστον μια χειρουργική αφαίρεση , συνήθως ακολουθούμενη και από επικουρική χημειο- και ακτινοθεραπεία.
Ο βαθμός εξαίρεσης του όγκου είναι αποφασιστικός για την μετέπειτα πορεία του ασθενούς. Ασθενείς με υψηλής αλλά και αυτοί με χαμηλής κακοήθειας γλοιώματα στους οποίους ο όγκος έχει αφαιρεθεί πλήρως εμφανίζουν καλύτερη πρόγνωση σε σχέση με τους ασθενείς στους οποίους έχει αφαιρεθεί μερικώς ή έχουν οδηγηθεί σε μια απλή βιοψία (Stummer W, 2008; Gousias K, 2014C; Gousias K, 2018). Σαφέστατα πρωταρχικός στόχος είναι ένα ασφαλές χειρουργείο χωρίς επιπλοκές , το οποίο στις μέρες μας μπορεί να διασφαλισθεί μέσω των σύγχρονων διεγχειρητικών τεχνικών, όπως η νευροπαρακολούθηση, η νευροπλοήγηση με απεικόνιση των δεσμίδων, η μικροχειρουργική υπό φθορισμό, η ενδοσκοπική νευροχειρουργική και τα χειρουργεία με ασθενή σε εγρήγορση.
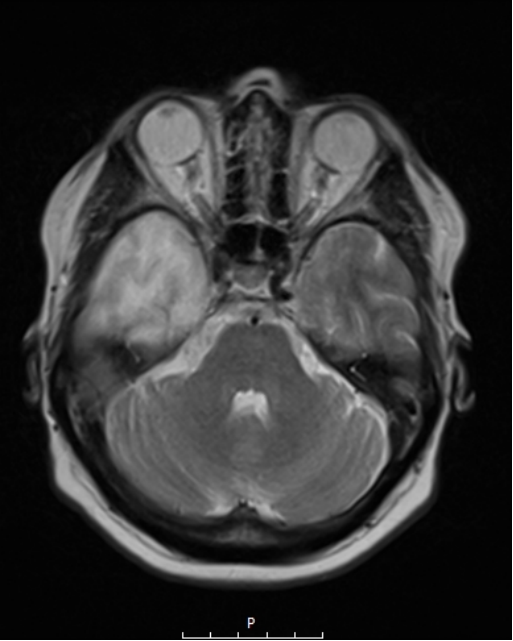
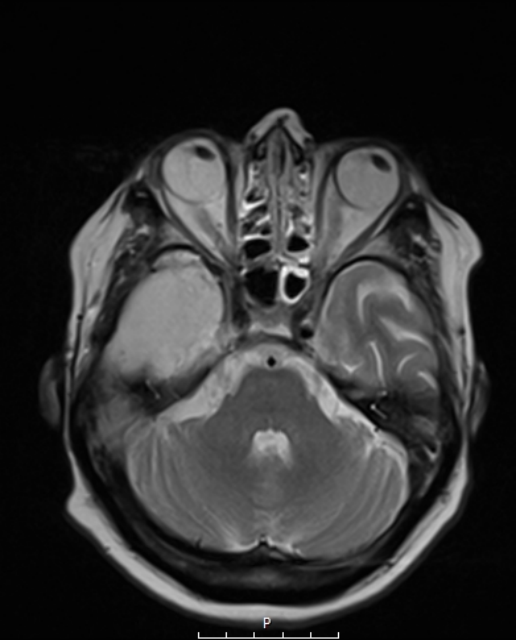
Ο συνδυασμός λοιπόν ενός ασφαλούς χειρουργείου με ταυτόχρονη ολική αφαίρεση του όγκου αποτελεί τον στόχο της σύγχρονης χειρουργικής νευρο-ογκολογίας. Μια υπερολική εξαίρεση στα πλαίσια μιας κροταφικής λοβεκτομής απεικονίζεται στις εικόνες 1 και 2. Αυτό είναι σαφέστατα πιο πιθανό να προσφερθεί από ειδήμονες νευροχειρουργούς (Gousias K, 2024) με ειδική εκπαίδευση σε μεγάλα κέντρα, μεγάλη χειρουργική εμπειρία και εξειδίκευση στην χειρουργική των όγκων καθώς και διεθνή αναγνώριση τους.
Η επιτροπή Χειρουργικής Νευρο-ογκολογίας της Ευρωπαϊκής Νευροχειρουργικής Εταιρείας δημοσίευσε το προφίλ ενός expert χειρουργού για όγκους εγκεφάλου και νωτιαίου μυελού (Gousias K, 2024).
Ανάλογα με τον ιστολογικό και μοριακό τύπο του όγκου, θα χρειαστεί και η αντίστοιχη επικουρική θεραπεία μετεγχειρητικά, η οποία μπορεί να αποτελείται είτε από ακτινοθεραπεία ή χημειοθεραπεία ή συνδυασμός και των δύο. Καινούργιες πειραματικές μέθοδοι, όπως η ανοσοθεραπεία εφαρμόζονται όλο και συχνότερα.
Enciso-Mora V, Gousias K et al, Deciphering the 8q24.21 association for glioma. Hum mol Genet 2013;22(11):2293-2302.
Encisio-Mora V, Gousias K et al. Low penetrance susceptibility to glioma is caused by the TP53 variant rs78378222. Br J Cancer 2013;108(10):2178-2185.
Gousias K et al, Descriptive epidemiology of cerebral gliomas on northwest Greece and study of potential predisposing factors, 2005-2007. Neuroepidemiology 2009;33(2):89-95.
Gousias K et al, Nuclear karyopherin a2:a novel biomarker for infiltrative astrocytomas. Neurooncol 2012;109(3):545-553
Gousias K et al, Frequent abnormalities of the immune system in gliomas and correlation with the WHO grading system of malignancy. J Neuroimmunol 2010;226(1-2):136-142
Gousias K et al. Phenotypical analysis, relation to malignancy and prognostic relevance of ICOS+ T regulatory and dentritic cells in patients with gliomas. J Neuroimmunol 2013;264(1-2):84-90.
Gousias K et al. Extent of resection and survival in supratentorial infiltrative low-grade gliomas: analysis of and adjustment for treatment bias. Acta Neurochir.2014;156(2):327-337
Gousias K et al. Expertise in Surgical Neurooncology. Results of a survey of EANS Neurooncology Section. Brain and Spine 2024;4:102822
Gousias K et al. KPNA2 predicts long term survival in patients with anaplastic oligoastrocytomas. J Clin Neurosc 2014;21(10):1719-1724
Gousias K et al, Prognostic value of the preoperative immunological profile in patients with glioblastoma. Surg Neurol Int 2014; 5:89
Gousias K et al. Mechanisms of Cell Cycle Arrest and Apoptosis in Glioblastoma. Biomedicines 2022; 10(3):564
Gousias K et al. Resektionsausmaß und Prognose bei Gliomen; ‘‘Viel hilft viel‘‘ oder ‘‘alles oder nichts‘‘?, In. Simon M, Gliomchirurgie, Springer Verlag, 2018
Jacobs DI, Gousias K et al. Leveraging ethnic group incidence variation to investigate genetic susceptibility to glioma: a novel candidate SNP approach. Front Genet 2012; 3:2023
Kinnersley B, Gousias K et al, Quantifying the heritability of glioma using genome-wide complex trait analysis. Sci Rep 2015;4:17267
Kinnersley B, Gousias K et al, Genome-wide association study identifies multiple susceptibility loci for glioma. Nature Commun.2015;6:8559.
Kinnersley B, Gousias K et al.Search for new loci and low-frequency variants influencing glioma risk by exome-array analysis. Eur J Hum Genet 2016;24(5):717-724
Martinez R, Gousias K Silencing of the nucleocytoplasmic shuttling protein karyopherin a2 promotes cell-cycle arrest and apoptosis in glioblastoma multiforme. Oncotarget 2018;9(71):33471-33481.
Louis DN et al, The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 2021;23(8):1231-1251
Melin BS, Gousias K et al, Genome-wide association study of glioma subtypes identifies specific differences in genetic susceptibility to glioblastoma and non-glioblastoma tumors. Nature Genetics 2017;49(5):789-794.
Sanson M, Gousias K et al, Chromosome 7p11.2 (EGFR) variation influences glioma risk. Hum Mol Genet 2011;20(14):2897-2904
Simon M, Gousias K et al, Genetic risk profiles identify different molecular etiologies for glioma. Clin Cancer Res 2010;16(21):5252-5259
Simon M, Gousias K et al. TERT promoter mutations: a novel independent prognostic factor in primary glioblastomas.Neuro Oncol 2015;17(1):45-52
Stummer W et al, Extent of resection and survival in glioblastoma multiforme: identification of and adjustment for bias. Neurosurgery 2008;62(3):564-76
Wang XW, Gousias K et al, Prognostic impact of isocitrate dehydrogenase 1 singel-nucleotide polymorphism rs11554137 in malignant gliomas. Cancer 2013;119(4)806-813
Ostrom QT et al, CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2016-2020. Neuro Oncol 2023;25(12 Suppl2):iv1-iv99.